
科目: 来源:不详 题型:单选题
| A.吸热反应需要加热才能发生 |
| B.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| C.将钾投入到氯化铝溶液中,能置换出单质铝 |
| D.砹在第6周期ⅦA族;根据元素周期律推断出它是一种有色固体,它的气态氢化 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| | X | | Y |
| Z | | W | |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 ,用化学用语回答下列有关问题:
,用化学用语回答下列有关问题:| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | | ⑧ | | ⑨ | |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | ||||
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ||||
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | | |
| 2 | | |
| 3 | | |
| 4 | | |
| 5 | | |
| 实验 序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
 2 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 |  | 100 | 振动球磨 | |
 = ;
= ;查看答案和解析>>
科目: 来源:不详 题型:单选题
电离能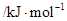 | 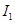 | 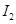 | 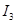 | 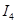 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| B.原子最外层电子数为1的元素一定处于周期表IA族 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 元素代号[ | X | Y | Z | W |
| 原子半径/nm | 0.130 | 0.118 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
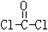 ,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.元素周期表有9个横行,分为9个周期 |
| B.元素周期表有7个横行,分为7个周期 |
| C.元素周期表有18个纵行,分为16个族 |
| D.元素周期表有18个纵行,分为18个族 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 g、Al的金属活动性顺序,某课外小组同学进行了如下实验:
g、Al的金属活动性顺序,某课外小组同学进行了如下实验: 他们记录的实验现象有:
他们记录的实验现象有:| 实验 现象 | ①剧烈反应,迅速生成大量的气体。 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红。 ③反应不剧烈,产生无色气体。 ④有气体产生,溶液变成红色。 |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 | | | | |
 反应的化学方程式___________________________________。
反应的化学方程式___________________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com