
科目: 来源:不详 题型:单选题
| A.第一电离能:B<C<N<O | B.最高正价:F>O>N>C |
| C.电负性:O>C>Si>Na | D.半径:Na + > Cl- |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.s轨道电子云图为哑铃形 |
| B.σ键的轨道重叠方式为“肩并肩”重叠 |
| C.C原子的价电子轨道表示式为:1s22s22p2 |
| D.n、l、m、ms组合可以为:2,1,0,1/2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
|
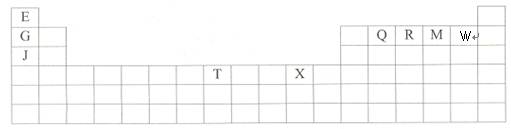 (1)X原子的价电子排布式是:______________________________________;
(1)X原子的价电子排布式是:______________________________________;查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题
| | I1 | I2 | I3 | I4 |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
| | 单键 | 双键 | 叁键 | |
| AB | 键能(kJ·mol―1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ·mol―1) | 154.8 | 418.4 | 941.7 |

查看答案和解析>>
科目: 来源:不详 题型:填空题
|
|
|
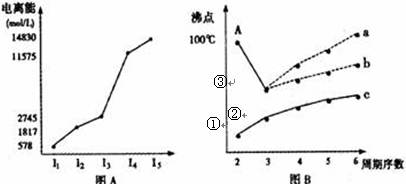 (2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律,①②③中表示为SiH4的是________
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律,①②③中表示为SiH4的是________

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.砷可以有-3、+3、+5等多种化合价 | B.砷原子的第3电子层含有18个电子 |
| C.H3AsO4的酸性比H3PO4弱 | D.砷的氢化物的稳定性比磷化氢的强 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.沸点: HI> HBr> HCl >>HF | B.原子半径大小: Na >Mg > O |
| C.酸性:HClO4>H2SO4>H2SiO3 | D.还原性强弱: F-< Cl-<I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com