
科目: 来源:不详 题型:单选题
| A.H2和Fe2O3 |
| B.CO和CuO |
| C.H2和Na2CO3 |
| D.CO和Na2CO3 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
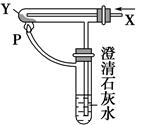
| A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数) |
| B.溶液中的CO32—离子浓度先增大后减小 |
| C.微热反应后的溶液,溶液的pH会升高 |
| D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系: |
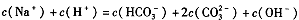
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题

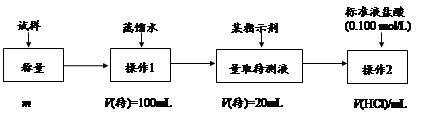
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.观察加热时是否放出气体 |
| B.观察滴加盐酸时能否放出气体 |
| C.溶于水中,再滴加石灰水,观察有无沉淀产生 |
| D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.100mL 0.1mol/L Na2CO3溶液中含有CO32-的数目小于0.01NA |
| B.热的碳酸钠溶液比冷的碳酸钠溶液洗涤餐具效果好 |
| C.用碳酸钠除去锅炉中的水垢(主要成分是CaSO4),使之转化为疏松、易溶于酸的碳酸钙。 |
| D.100mL 0.1mol/L Na2CO3溶液中:n(CO32-)+n(HCO3-)+n(OH?)=0.01mol |
查看答案和解析>>
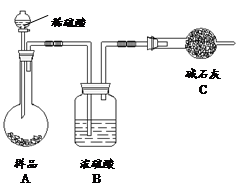
科目: 来源:不详 题型:实验题
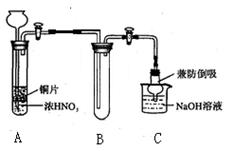
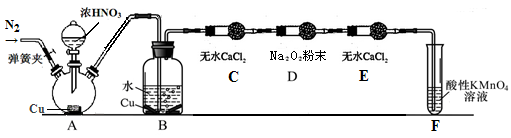
查看答案和解析>>
科目: 来源:不详 题型:实验题
| | | 氨碱法 | 联合制碱法 |
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
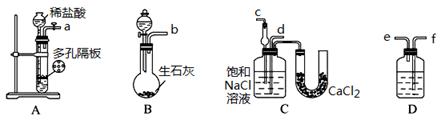
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Na2CO3 | B.Na2O2,Na2CO3 |
| C.NaOH,Na2CO3 | D.Na2O2,NaOH,Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com