
科目: 来源:不详 题型:单选题
 两份铝粉,第一份加足量NaOH溶液,第二份加足量稀硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是
两份铝粉,第一份加足量NaOH溶液,第二份加足量稀硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是| A.1∶2 | B.1∶3 | C.3∶2 | D.1∶1 |
查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.铝片与盐酸反应生成氢气 | B.氢氧化铝溶于强碱溶液 |
| C.氢氧化铝溶于强酸溶液 | D.铝热反应 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 Cl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为
Cl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为| A.1:2 | B.1:1 | C.1:3 | D.2:1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
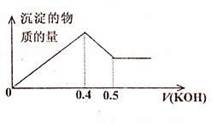
| A.1:3 | B.2:3 | C.3:1 | D.6:1 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 硫酸转移到容量瓶中。
硫酸转移到容量瓶中。 盖上容量瓶塞子,振荡,摇匀。
盖上容量瓶塞子,振荡,摇匀。查看答案和解析>>
科目: 来源:不详 题型:填空题
 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。 极反应式:
极反应式: 查看答案和解析>>
科目: 来源:不详 题型:填空题
A.Al(OH)3可溶于强碱溶液中,M g(OH)2不能 g(OH)2不能 |
| B.Mg能从铝盐溶液中置换出铝 |
| C.Mg 原子最外层只有2个电子, 而Al原子最外层有3个电子 |
| D.Mg与盐酸反应比铝与盐酸反应更剧烈 |
 点,都可以制耐火材料,其原因是_____________________
点,都可以制耐火材料,其原因是_____________________查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.在加入铝粉能放出氢气的溶液中K+、NH4+、CO32—、C1—可能大量共存 |
| B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,能发生“先沉淀后溶解”现象 |
| C.向饱和碳酸钠溶液中通入过量CO2的离子方程式为: 2Na++CO32—+CO2+H2O |
| D.0.1mol·L—1乙酸溶液的pH约为3,可证明它是弱电解质 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.X既可以是HCl,也可以是NaOH |
B.第②步反应的离子方程式为: |
| C.固体L中含有SiO2、Fe2O3和MgO等 |
| D.滤液N经蒸发结晶后可以得到纯净的Na2CO3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com