
科目: 来源:不详 题型:填空题
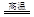 6Cu+SO2
6Cu+SO2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1︰1︰3 |
| B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为2︰1 |
| C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 |
| D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| | | |
| | | |
查看答案和解析>>
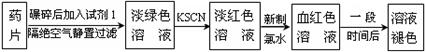
科目: 来源:不详 题型:实验题
查看答案和解析>>
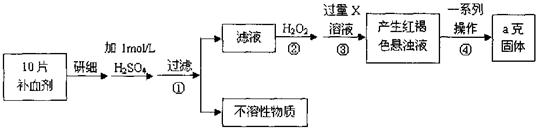
科目: 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | _________________。 | 说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明:________________________。 |
查看答案和解析>>
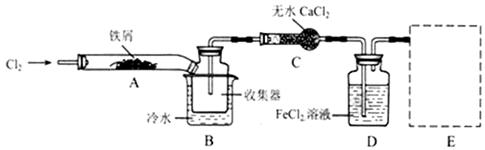
科目: 来源:不详 题型:单选题
| A.有Fe2+ | B.Cu2+、Fe2+ 和Fe3+ |
| C.仅有 Fe3+ 和Fe2+ | D.有Cu2+和Fe2+ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
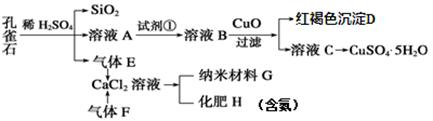

查看答案和解析>>
科目: 来源:不详 题型:单选题
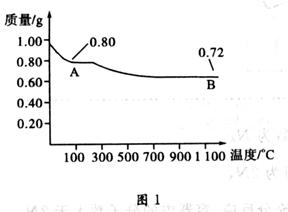

查看答案和解析>>
科目: 来源:不详 题型:填空题
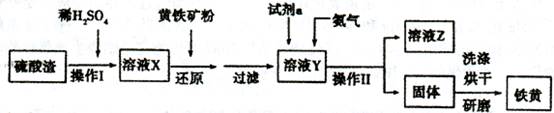
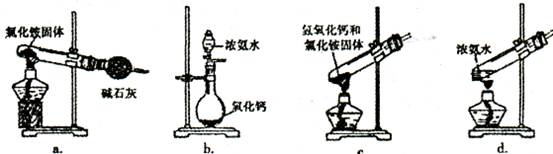
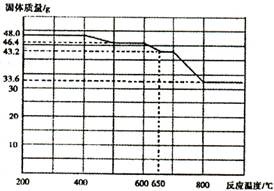
| 加入试剂 | 现象 | 结论 |
| | | 则还原产物为 |
| | | |
| | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com