
科目: 来源:不详 题型:填空题
 H2O。
H2O。 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)查看答案和解析>>
科目: 来源:不详 题型:计算题
 量浓度以及产生氢气的体积。(注:氢气的体积测定环境为标准状况)
量浓度以及产生氢气的体积。(注:氢气的体积测定环境为标准状况)查看答案和解析>>
科目: 来源:不详 题型:单选题
A.不溶物一定是Cu | B.溶液中一定含有Fe2+,但不一定含有Cu2+ |
| C.不溶物一定是Fe | D.不溶物一定含铜,但不一定含铁 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题
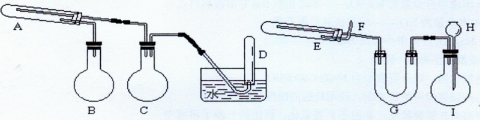
查看答案和解析>>
科目: 来源:不详 题型:填空题
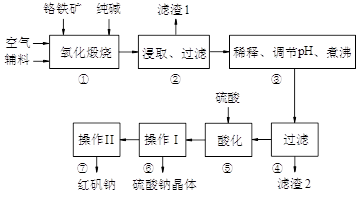
 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等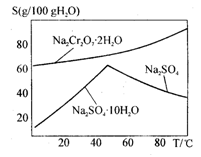
 是______(填序号)。
是______(填序号)。查看答案和解析>>
科目: 来源:不详 题型:单选题
| | 已知 | 类推 |
| A | 将Fe加 入到CuSO4溶液中 入到CuSO4溶液中Fe + Cu2+ =" Cu" + Fe2+ | 将Na加入到CuSO4溶液中 2Na + Cu2+ =" Cu" + 2Na+ |
| B | 氢氧燃料电池的负极反应(稀硫酸作电解质溶液):H2 – 2e— = 2H+ | 氢氧燃料电池的负极反应(氢氧化钾溶液作电解质溶液):H2 – 2e— + 2OH—=2H2O |
| C | 用惰性电极电解CuSO4溶液 2Cu2++ 2H2O  4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu | 用惰性电极电解CuCl2溶液 2Cu2+ + 2H2O  4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+ 2H+ = Ca2+ + H2O + CO2↑ | 将少量CaCO3粉末投入足量醋酸溶液中 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com