
科目: 来源:不详 题型:单选题
| A.(a-0.8)g | B.(a-1.6)g | C.1.6ag | D.0.8ag |
查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:单选题
 中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无变化,下面结论正确的是
中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无变化,下面结论正确的是| A.不溶物一定是铜 | B.不溶物一定是铁  |
C.不溶物 中一定含铜,但不一定含铁 中一定含铜,但不一定含铁 | D.溶液中一定含有FeSO4,可能含有CuSO4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.常温下,“纳米铜”比铜片的金属性强 | B.常温下,“纳米铜”比铜片更易失电子 |
| C.常温下,“纳米铜”与铜片的还原性相同 | D.常温下,“纳米铜”比铜片的氧化性强 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2Cu+SO2
2Cu+SO2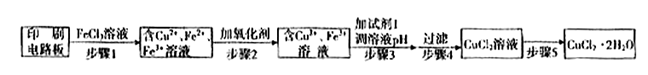 ①证明步骤I所加FeCl3溶液过量的方法是 。
①证明步骤I所加FeCl3溶液过量的方法是 。 O2(g)==H2O(l) △H3=-286kJ/mol
O2(g)==H2O(l) △H3=-286kJ/mol
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.45.8% | B.57.6% | C.72.3% | D.无法确定 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 矿石名称 | 磁铁矿 | 黄铁矿 | 赤铁矿 | 黄铜矿 |
| 主要成分 | Fe3O4 | FeS2 | Fe2O3 | CuFeS2 |
 2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.铁元素在周期表的位置是第四周期第ⅦB族 |
| B.常温下,铁不与浓硫酸或浓硝酸的反应 |
| C.铁与水蒸汽在高温下的反应产物为Fe2O3和H2 |
| D.可以用化合反应制备Fe(OH)3 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.该反应中氧化剂与还原剂物质的量之比为1︰8 |
| B.若有lmol NO3— 发生还原反应,转移电子数为5mol |
| C.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
| D.若把该反应设计成原电池,负极反应为Fe2+—e— =Fe 3+ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
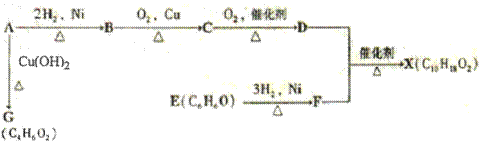
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com