
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.铁 | B.锌 | C.钛 | D.镍 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
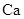 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数) 。
。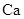 元素在周期表中位置是 ,其原子结构示意图 ;
元素在周期表中位置是 ,其原子结构示意图 ;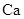 与最活跃的非金属元素A形成化合物D,D的电子式为 ;
与最活跃的非金属元素A形成化合物D,D的电子式为 ;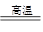 Ca3(PO4)2 + Fe;
Ca3(PO4)2 + Fe;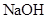 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测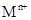 的方法是 (用离子方程式表达);
的方法是 (用离子方程式表达);查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
 Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。
Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。| A.加NaOH | B.加盐酸 | C.加硫酸 | D.加AgNO3 |
查看答案和解析>>
科目: 来源:不详 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com