
科目: 来源:不详 题型:单选题
| A.人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| B.太阳能电池可利用硅材料制作,其应用有利于节能环保 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解除去 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①② | B.②③ | C.①⑤ | D.①③④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体 |
| B.将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色 |
| C.将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体 |
| D.将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.辉石、斜长石及橄榄石均属于硅酸盐 |
| B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2 |
| C.橄榄石中铁为+2价 |
| D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题
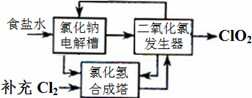
 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).查看答案和解析>>
科目: 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com