
科目: 来源:不详 题型:实验题
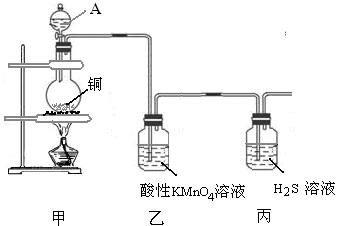
查看答案和解析>>
科目: 来源:不详 题型:实验题
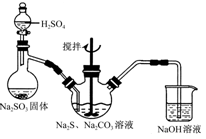
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.被酸雨污染的农田及湖泊可洒石灰石粉末;减轻其危害 |
| B.在溶液BaCl2中通入SO2气体,溶液仍登清,滴入3%过氧化氢溶液有白色沉淀 |
| C.能与水反应生成硫酸 |
| D.二氧化硫能使品红溶液褪色,加热,品红溶液颜色恢复 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.湿润的蓝色石蕊试纸先变红后褪色 |
| B.左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性 |
查看答案和解析>>
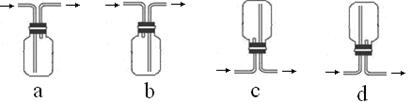
科目: 来源:不详 题型:单选题

| 选项 | 实验现象 | 解释或结论 |
| A | a中溴水褪色 | 还原性:SO32—> Br— |
| B | b中加硫酸后产生淡黄色沉淀 | SO32—和S2—在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32—+H2O HSO3—+OH—,所以滴入酚酞变红; HSO3—+OH—,所以滴入酚酞变红;Ba2++SO32—→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性 |
| B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性 |
| C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性 |
| D.常温下浓硫酸可以用铝罐储存,说明铝与冷的浓硫酸不反应 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.通过品红溶液 |
| B.通过澄清石灰水 |
| C.先通过氢氧化钠溶液,再通过澄清石灰水 |
| D.先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 |
| B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 |
| C.运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
| D.向5 mL 18 mol·L-1的硫酸中加入足量铜片并加热使其充分反应,生成0.045 mol SO2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
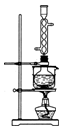
科目: 来源:不详 题型:实验题
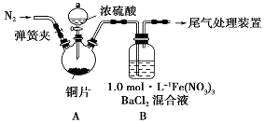
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com