
科目: 来源:不详 题型:单选题
| A.硫粉在过量的氧气中燃烧可以生成SO3 |
| B.可以用澄清石灰水鉴别CO2和SO2 |
| C.将少量CO2通入BaCl2溶液能生成白色沉淀 |
| D.不能用排水法收集SO2、NO2气体 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
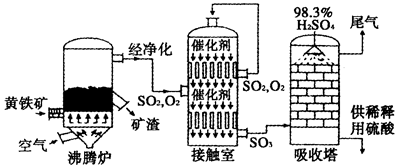
查看答案和解析>>
科目: 来源:不详 题型:问答题

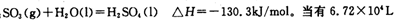 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 事实 | 解释 |
| A | 用铝罐槽车储运浓硫酸 | 浓硫酸的强氧化性使铝钝化 |
| B | 用饱和NH4Cl溶液处理过的舞台布帘可防火 | NH4Cl分解吸热,且分解产物能隔绝空气中的氧气 |
| C | 钠元素的焰色反应呈黄色 | Na2O2是一种淡黄色的固体 |
| D | SO2能使溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
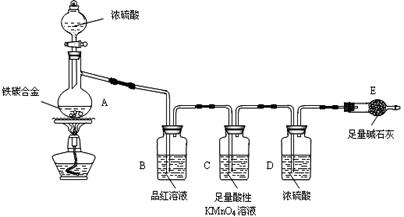
查看答案和解析>>
科目: 来源:不详 题型:实验题
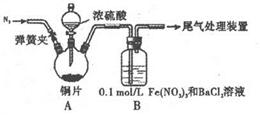
| A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴 |
| B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定其产生气体的体积(折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况) |
查看答案和解析>>
科目: 来源:不详 题型:实验题
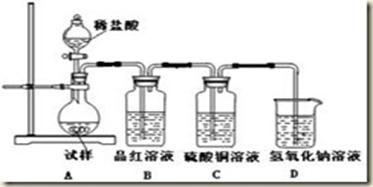
查看答案和解析>>
科目: 来源:不详 题型:实验题
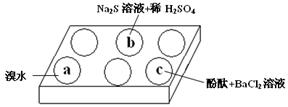
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
| n(SO32—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
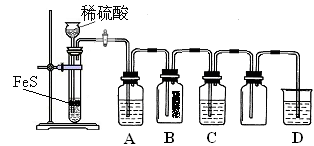
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
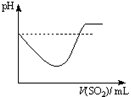 | 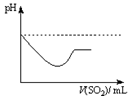 | 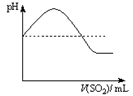 | 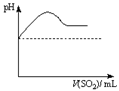 |
| A | B | C | D |
查看答案和解析>>
科目: 来源:不详 题型:实验题
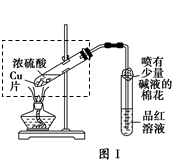
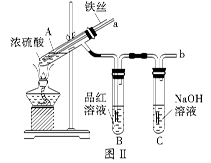
| 步骤 | 所选试剂 | 现象及结论 |
| 1 | | |
| 2 | | |
| 3 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com