
科目: 来源:不详 题型:填空题
 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I- 2
C6H6O6+2H++2I- 2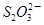 +I2
+I2
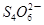 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。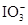 +5
+5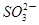 +2H+
+2H+ I2+5
I2+5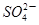 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 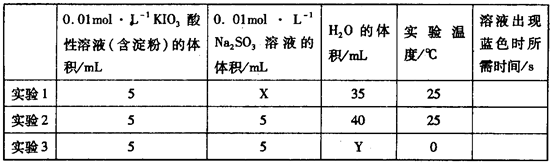
 Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:填空题
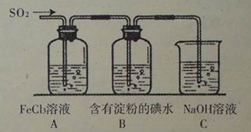
| A.蒸发皿 | B.石棉网 | C.漏斗 | D.烧杯 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Fe2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
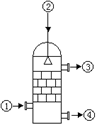
| A.从①处通入含SO3的混合气体,整个吸收操作采取逆流的形式 |
| B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 |
| C.从③处导出的尾气中含量最高的气体是SO2,所以不可直接排入大气 |
| D.从④处流出的是可用水或稀硫酸稀释的“发烟”硫酸 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Ba(NO3)2、HCl | B.BaCl2、NaCl | C.NH4Cl、CaCl2 | D.MgCl2、(NH4)2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com