
科目: 来源:不详 题型:填空题
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50 | 0.896 |
| 2 | 7.24 | 50 | 1.792 |
| 3 | 10.86 | 50 | 2.016 |
| 4 | 14.48 | 50 | 1.568 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加入NaOH,溶液pH升高,c(SO32-)增大 |
| B.氯化钡有两性 |
| C.两支试管中的白色沉淀都是BaSO4 |
| D.SO2具有两性且水溶液有酸性 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.二氧化硫能漂白某些物质,说明它具有氧化性 |
| B.二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5mL3%的过氧化氢后产生沉淀 |
| C.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 |
| D.二氧化硫漂白过的草帽过一段时间后又会恢复到原来的颜色 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染 |
| B.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸 |
| C.两种气体都具有强氧化性,因此都能够使品红溶液褪色 |
| D.两种气体溶于水都可以与水反应,且只生成相应的酸 |
查看答案和解析>>
科目: 来源:不详 题型:实验题


 。
。查看答案和解析>>
科目: 来源:不详 题型:填空题
 Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:查看答案和解析>>
科目: 来源:不详 题型:单选题
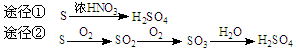
| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- |
| D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com