
科目: 来源:不详 题型:实验题
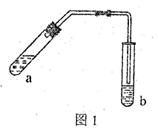
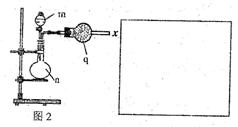
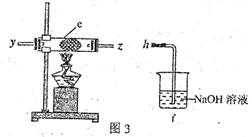
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则水电离的热化学方程式为:H2O(l) H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1 H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1 |
| D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+ |
查看答案和解析>>
科目: 来源:不详 题型:填空题

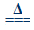 2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3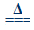 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。查看答案和解析>>
科目: 来源:不详 题型:填空题
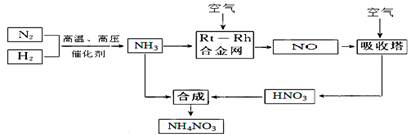
查看答案和解析>>
科目: 来源:不详 题型:实验题
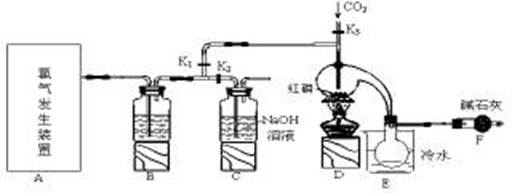
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.NH3是4核10电子的分子,三角锥形,具有还原性 |
| B.NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂 |
| C.氨气是非电解质,氨水是电解质 |
| D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①③ | B.②④ | C.③④ | D.只有① |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.5a mol | B.2a mol | C.0.1a mol | D.(0.1+a)mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.1︰4 | B.1︰5 | C.2︰3 | D.2︰5 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
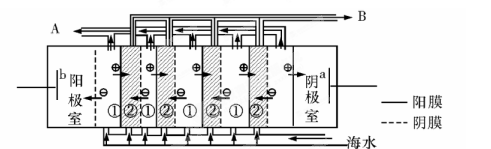
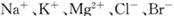 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com