
科目: 来源:不详 题型:单选题
A.0.2 mol | B.0.3 mol | C.0.4 mol | D.0.5mol |
查看答案和解析>>
科目: 来源:不详 题型:实验题

 的化学方程式为 。
的化学方程式为 。 水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。 应的化学方程式
应的化学方程式  ;
; 
查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:实验题
 实验方案验证Ag与浓HNO3反应的
实验方案验证Ag与浓HNO3反应的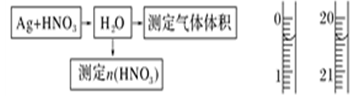
 液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置
液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置 如上图所示。在B容器中生成硝酸的物质的量为__
如上图所示。在B容器中生成硝酸的物质的量为__ __________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。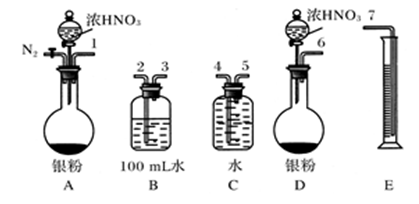
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:填空题
 。
。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.N2O | B.NO | C.N2O3 | D.NO2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 ;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是| A.所消耗的硝酸的量:①>②>③ |
| B.对环境造成的危害,③最小 |
| C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是① |
| D.三种途径所消耗的铜的质量不相等 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.40.32L | B.30.24L | C.20.16L | D.6.72L |
 不可行,请说明原因。若可行,请写出反应的离子方程式: 。
不可行,请说明原因。若可行,请写出反应的离子方程式: 。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Na2CO3遇浓硝酸放出CO2气体 |
| B.Fe在冷浓硝酸中发生钝化现象 |
| C.分别沾有浓氨水和浓硝酸的两支玻璃棒互相靠近产生白烟 |
| D.Fe(OH)3不溶于水,但能溶于浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com