
科目: 来源:不详 题型:单选题
| A.N2O与SiO2为等电子体、具有相似的结构(包括电子式) |
B.N2O的电子式可表示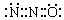 |
| C.N2O与CO2均不含非极性键 |
| D.N2O为三角形分子 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.I2微溶于水,易溶于CCl4;HCl易溶于水 |
| B.在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH |
| C.不同的烃之间相互溶解 |
| D.I2易溶于KI溶液中 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.该物质分子式为K3C60 |
| B.K3C60的摩尔质量是837 |
| C.1molK3C60中含有的离子键的数目为63×6.02×1023个 |
| D.K3C60中既有离子键 ,又有共价键 ,在熔融状态下能导电 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①②⑤ | B.①②④⑤ | C.①②③④⑤ | D.①③④⑤ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.离子晶体的晶格能越大,离子晶体的熔点越高 |
| B.碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为CCl4和I2都是非极性分子,而H2O是极性分子 |
| C.成键原子的原子轨道重叠越多,共价键越牢固 |
| D.含有金属阳离子的晶体一定是离子晶体 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.当中心原子的配位数为6时,配合单元常呈八面体空间结构 |
| B.[Ag(NH3)2]+中Ag+空的5S轨道和5P轨道以sp杂化成键 |
| C.配位数为4的配合物均为正四面体结构 |
| D.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.P4和NO2都是共价化合物 |
| B.CCl4和NH3都是以极性键结合的极性分子 |
| C.在CaO和SiO2晶体中,都不存在单个小分子 |
| D.在冰(固态水)中,既有极性键、非极性键,又有氢键 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
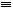 O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y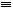 Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):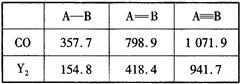
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com