
科目: 来源:不详 题型:填空题
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
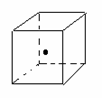
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.氯化硼液态时能导电而固态时不导电 | B.硼原子以sp杂化 |
| C.氯化硼遇水蒸气会产生白雾 | D.氯化硼分子属极性分子 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
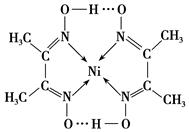
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
 ②
② 、③
、③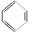 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。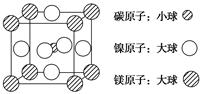
查看答案和解析>>
科目: 来源:不详 题型:单选题
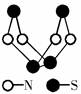
| A.该物质的分子式为SN | B.该物质的分子中既有极性键又有非极性键 |
| C.该物质具有很高的熔、沸点 | D.该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
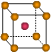
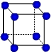
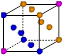
| | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| | 9540 | 10540 | 11578 |
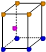

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.冰溶化时,分子中H—O键发生断裂 |
| B.在晶体中只要有阳离子,一定有阴离子 |
| C.离子化合物中可能含有非极性共价键 |
| D.在SiO2晶体中,Si原子与Si—O键数目比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com