
科目: 来源:不详 题型:单选题
| A.加热碘化氢气体使之分解只需克服分子间作用力 |
| B.氯化氢溶于水能电离出H+、Cl-,所发氯化氢是离子化合物 |
| C.氧气与臭氧相互转化属于化学变化 |
| D.碘晶体和碘蒸气是同素异形体 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 化学键 | Si-O | Si-Cl | H-Cl | Si-Si |
| 键能/KJ·mol-1 | 460 | 360 | 431 | 176 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
查看答案和解析>>
科目: 来源:不详 题型:填空题
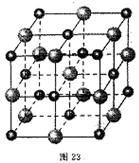
查看答案和解析>>
科目: 来源:不详 题型:填空题
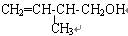 ,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)
,该有机物中所含官能团的名称是_______________________________,写出该有机物属于酮的同分异构体(用结构简式表示)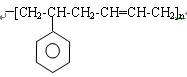
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.固体碘转化为紫红色气体,需吸收能量,因共价键被破坏 |
| B.碳酸氢铵是典型离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键 |
| C.金属和非金属所形成的化学键均为离子键 |
| D.共价键只存在于共价化合物中 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
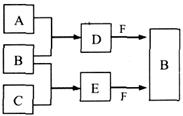
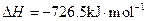 ,氢气的燃烧热
,氢气的燃烧热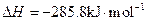 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com