
科目: 来源:不详 题型:单选题
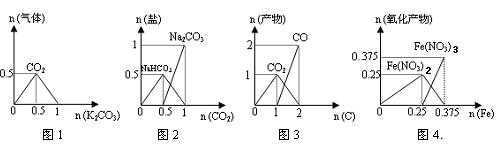
| A.图1:n(HCl)=1mol,K2CO3加入到HCl溶液中,在敞口容器中生成的气体 |
| B.图2:n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 |
| C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 |
| D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.(a+3b)mol | B.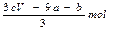 |
C.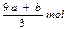 | D.(cV-3a-9b)mol |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
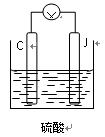
查看答案和解析>>
科目: 来源:不详 题型:填空题

 TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1查看答案和解析>>
科目: 来源:不详 题型:单选题
| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | HCl | Ba(OH)2 |
| B | NO2 | SO2 | BaCl2 |
| C | FeCl2 | FeCl3 | KSCN |
| D | AlCl3 | MgCl2 | NH3·H2O |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.石灰水中通入过量二氧化碳 | B.氯化铝溶液中加氨水 |
| C.碳酸钠溶液中加盐酸 | D.BaCl2溶液中通入二氧化碳 |
查看答案和解析>>
科目: 来源:不详 题型:计算题
 。(保留2位小数)
。(保留2位小数)查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染物气体,在空气中都能温室存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液显红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com