
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:单选题
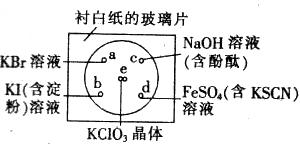
| A.a处溶液显黄色:2Br—+Cl2=2Cl—+Br2 |
| B.b处溶液显蓝色:2I—+Cl2=2Cl—+I2 |
| C.c出溶液的红色褪去:2OH—+Cl2=Cl—+ClO—+H2O |
| D.d处溶液显红色:Fe2++Cl2=Fe3++2Cl— |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.b/100 mol | B.m/60 mol | C.(b/100—m/60)mol | D.(m/60—b/100)mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
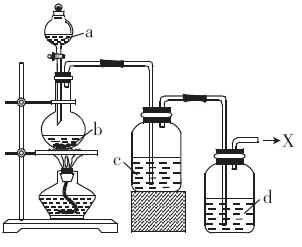
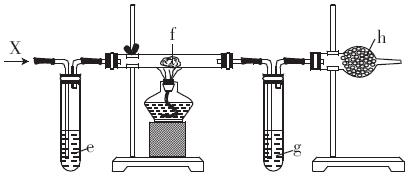
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.可用酸性高锰酸钾溶液检验FeSO4溶液是否变质 |
| B.温度为t2时,固体B的化学式为FeO |
| C.在隔绝空气条件下A得到B的化学方程式为 FeSO4  FeO+SO3 FeO+SO3 |
| D.若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为FeO |
查看答案和解析>>
科目: 来源:不详 题型:填空题
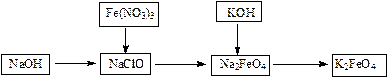
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.1molZn与含1molHCl的稀盐酸共热 |
| B.1molCu与含2molH2SO4的浓硫酸共热 |
| C.1molCu与含4molHNO3的浓硝酸 |
| D.1molMnO2与含4molHCl的浓盐酸共热 |
查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.氢气在氯气中燃烧,火焰呈苍白色,产生大量白雾 |
| B.硫在空气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 |
| C.铜在氯气中燃烧,产生白烟,加水溶解后可能得到绿色溶液 |
D.用洁净的玻璃棒蘸取碳酸钾粉 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com