
科目: 来源:不详 题型:问答题
时间(h) 钾元素 温度熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| C.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | |||||||||||||||||
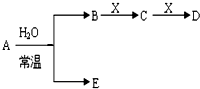
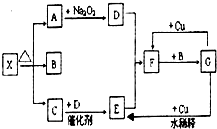
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.②、⑧、⑨对应简单离子半径依次减小 |
| B.⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C.元素⑩处于常见周期表第四周期第VⅢB族 |
| D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
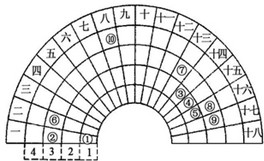
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 实验方案 (只填写选用试剂序号) | 实验现象 | 结论 | |
| (1) | ______ | 一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性:______ |
| (2) | ______ | ______ | 非金属性:Cl>Br |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.原子核内有8个中子的碳原子:
| ||
| B.1H2和2H2互为同位素 | ||
C.
| ||
D.硫原子的结构示意图: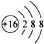 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com