
科目: 来源:不详 题型:填空题

 键与
键与 键的个数比为 。
键的个数比为 。查看答案和解析>>
科目: 来源:不详 题型:填空题


 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
| A.乙中左侧电极反应式:Cu2++2e-=Cu |
| B.电解一段时间后,装置丙的pH减小 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为; |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 、
、 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定 中化学键类型为________。
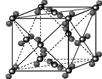
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1) 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性, 的分子构型是__________,
的分子构型是__________, 中Xe原子的杂化类型是_______,与
中Xe原子的杂化类型是_______,与 分子互为等电子体的离子有___________(填一种)。
分子互为等电子体的离子有___________(填一种)。查看答案和解析>>
科目: 来源:不详 题型:填空题


查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |



查看答案和解析>>
科目: 来源:不详 题型:填空题
 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。| A.NH3分子中N原子采用sp3杂化 |
| B.相同压强时,NH3沸点比PH3高 |
| C.[Cu (NH3)4]2+离子中,N原子是配位原子 |
| D.CN-的电子式为[:C┇┇N:]- |


查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题


查看答案和解析>>
科目: 来源:不详 题型:填空题
 (一)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(一)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |

查看答案和解析>>
科目: 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com