
科目: 来源:不详 题型:单选题
| A.4种 | B.5种 | C.6种 | D.7种 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH– CO32– SO42– |
查看答案和解析>>
科目: 来源:不详 题型:单选题
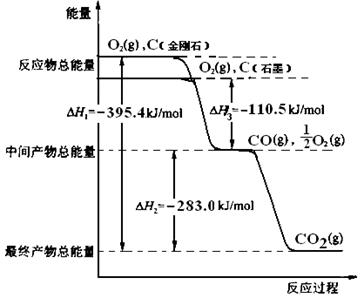
查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

A.2H+(aq) +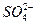 (aq)+ (aq)+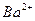 (aq)+2OH (aq)+2OH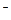 (aq)=BaSO4(s)+2H (aq)=BaSO4(s)+2H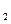 O(1); O(1);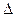 H= H=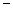 57.3 kJ/mol 57.3 kJ/mol | B.KOH(aq)+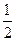 H H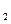 SO4(aq)= SO4(aq)= 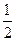 K K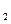 SO4(aq)+H SO4(aq)+H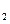 O(I); O(I);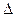 H= H=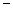 57.3kJ/mol 57.3kJ/mol | C.C8H18(I)+ 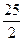 O O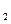 (g)=8CO (g)=8CO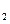 (g)+ 9H (g)+ 9H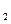 O; O;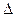 H= H=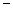 5518 kJ/mol 5518 kJ/mol | D.2C8H18(g)+25O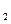 (g)=16CO (g)=16CO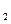 (g)+18H (g)+18H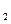 O(1); O(1); H= H=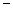 5518 kJ/mol 5518 kJ/mol   |
查看答案和解析>>
科目: 来源:不详 题型:单选题
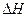 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e-  H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 PtF6(g)+ e-1
PtF6(g)+ e-1 PtF6-(g)
PtF6-(g)  H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-  H3="482.2" kJ·mol-1
H3="482.2" kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。查看答案和解析>>
科目: 来源:不详 题型:填空题
 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。 a.NaOH b.Zn c.Fe d.NH3·H2O
a.NaOH b.Zn c.Fe d.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
。若电解电路中通过2mol电子,MnO2的理论产量为 。查看答案和解析>>
科目: 来源:不详 题型:填空题
 请回答氯碱的如下问题:
请回答氯碱的如下问题: (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果); (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号) (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。 ①
①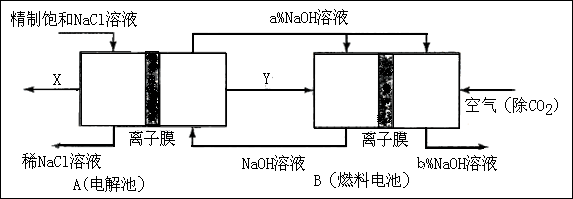 图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________; ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____; ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH4(g)+HC≡CH(g)+H2(g);△H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g);△H1="156.6" kJ·mol-1 CH4(g)+HC=CH(g);△H2="32.4" kJ·mol-1
CH4(g)+HC=CH(g);△H2="32.4" kJ·mol-1 CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com