
科目: 来源:不详 题型:填空题
查看答案和解析>>
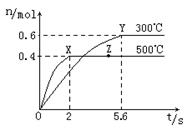
科目: 来源:不详 题型:填空题
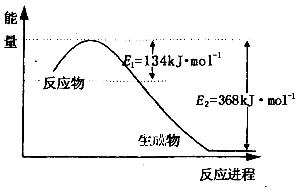
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0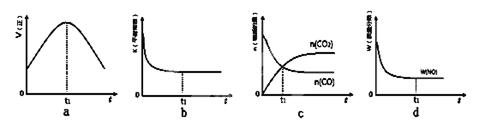
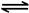 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
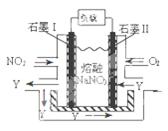
查看答案和解析>>
科目: 来源:不详 题型:填空题
 N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________; 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
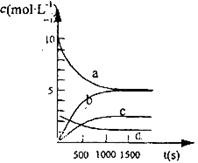
查看答案和解析>>
科目: 来源:不详 题型:填空题

 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。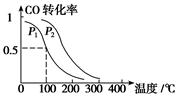
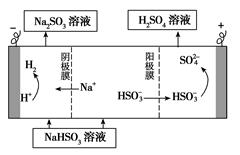
查看答案和解析>>
科目: 来源:不详 题型:填空题
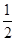 O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1查看答案和解析>>
科目: 来源:不详 题型:填空题
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
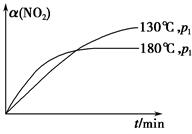
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.H2(g)+Br2(g)=2HBr(g) ΔH=-2Q kJ·mol-1 |
| B.H2(g)+Br2(l)=2HBr(g) ΔH=-Q kJ·mol-1 |
C.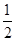 H2(g)+ H2(g)+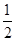 Br2(g)=HBr(g)ΔH=+ Br2(g)=HBr(g)ΔH=+ kJ·mol-1 kJ·mol-1 |
D.HBr(g)=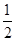 H2(g)+ H2(g)+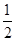 Br2(g)ΔH=+ Br2(g)ΔH=+ kJ·mol-1 kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
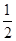 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2| A.①②③ | B.②④ | C.②③④ | D.③④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com