
科目: 来源:不详 题型:填空题
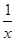 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol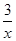 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究: 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。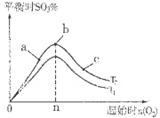
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g)
2NO(g)  H>0
H>0查看答案和解析>>
科目: 来源:不详 题型:填空题
 2N (g)
2N (g) 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:查看答案和解析>>
科目: 来源:不详 题型:填空题

 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
查看答案和解析>>
科目: 来源:不详 题型:填空题

A.反应处于平衡状态时, |
B.反应达到平衡后, |
| C.体系的总压强不变,说明反应已达平衡 |
| D.混合气体的密度保持不变,说明反应已达平衡 |
 ①
①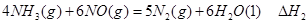 ②
② ③
③ 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式, =_________。
=_________。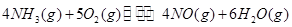
 =
=


| 时间/浓度 |   |   |   |   |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | a | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |

查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
 CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。 CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
 CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由查看答案和解析>>
科目: 来源:不详 题型:单选题
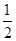 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2| A.② | B.①② | C.①③ | D.②③ |
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:单选题
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1| A.+41.2 kJ?mol-1 | B.-41.2 kJ?mol-1 | C.+82.4kJ?mol-1 | D.-524.8 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com