
科目: 来源:不详 题型:填空题
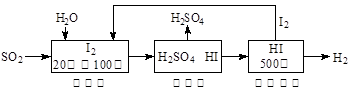
 Ni(OH)2+M
Ni(OH)2+M查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题
 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题



查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1 CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1 CO2(g)+H2(g);△H=-41.3kJ·mol-1
CO2(g)+H2(g);△H=-41.3kJ·mol-1 CH3OCH3(g)+CO2(g)的△H= ;
CH3OCH3(g)+CO2(g)的△H= ; CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L) | 0.44 | 0.6 | 0.6 |
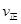 _______
_______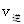 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
科目: 来源:不详 题型:填空题
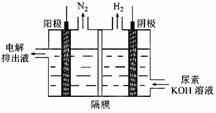
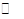 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1| A.采用高温 |
| B.采用高压 |
| C.寻找更高效的催化剂 |
| D.减小体系内CO2浓度 |
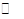 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1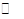 H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0·30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:查看答案和解析>>
科目: 来源:不详 题型:填空题
 .
. 、一283.0 kJ
、一283.0 kJ 和一726.5.kJ
和一726.5.kJ 。请回答下列问题:
。请回答下列问题: 、
、 均大于300℃):
均大于300℃):
 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
 时的平衡常数比
时的平衡常数比 时的小
时的小 变到
变到 ,达到平衡时
,达到平衡时 增大
增大 温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.21.44kJ | B.600.20kJ | C.21435.71kJ | D.1965.10kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com