
科目: 来源:不详 题型:单选题
| A.吸收183KJ | B.吸收248KJ | C.放出183KJ | D.放出366KJ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.+283.5kJ·mol-1 | B.+172.5kJ·mol-1 |
| C.-172.5kJ·mol-1 | D.-504kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
 N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.2 CH4 (g)+4O2(g)=2CO2(g) +4H2O(l)△H=+890KJ/mol |
| B.CH4 +2 O2=CO2+2H2O△H=-890KJ/mol |
| C.CH4 (g)+2O2(g)=CO2(g) +2H2O(l)△H=-890KJ/mol |
| D.1/2 CH4 (g)+O2(g)= 1/2CO2(g) +H2O(l)△H=-890KJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。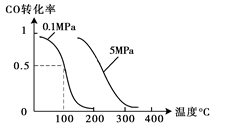
 Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。查看答案和解析>>
科目: 来源:不详 题型:单选题
A.H2(g) + I2(s) 2HI(g) - 26.5kJ 2HI(g) - 26.5kJ |
B.H2 + I2 2HI - 53kJ 2HI - 53kJ |
C.H2(g) + I2(s) 2HI(g) - 53kJ 2HI(g) - 53kJ |
D.0.5H2 + 0.5I2 HI - 26.5kJ HI - 26.5kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2 -2△H1 | D.△H1-5△H2-12△H3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com