
科目: 来源:不详 题型:单选题
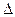 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1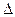 H2=" +771.1" kJ·mol-1
H2=" +771.1" kJ·mol-1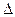 H3=" -482.2" kJ·mol-1
H3=" -482.2" kJ·mol-1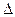 H是
H是| A.77.6 kJ | B.-77.6 kJ·mol-1 | C.+77.6kJ·mol-1 | D.-886.8kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )| A.1.8△H | B.2△H | C.△H | D.0.9△H |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )| A.2H+(aq) +SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);ΔH=-57.3 kJ/mol |
B.KOH(aq )+ )+ H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol |
| C.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1);ΔH=-5518 kJ/mol |
| D.C8H18(l)+ 25/2 O2(g)=8CO2(g)+ 9H2O(1);ΔH=-5518 kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.─484KJ/moL | B.+484KJ/moL | C.─242KJ/moL | D.+242KJ/moL |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 成甲醇:CO(g)+2H2(g)
成甲醇:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH| 250℃: K1=__________ | 300℃: K2=0.270 | 350℃: K3=0.012 |
 ,
,
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低 |
| B.稀硫酸与稀NaOH溶液反应的中和热△H=57.3 kJ/mol |
| C.碳的燃烧热大于-110.5 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,△H 大于 -57.3 kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:计算题
 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。 查看答案和解析>>
科目: 来源:不详 题型:填空题
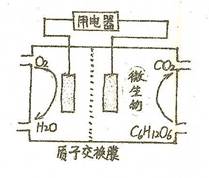
查看答案和解析>>
科目: 来源:不详 题型:填空题
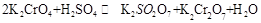
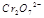 在水溶液中为红色,
在水溶液中为红色,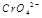 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。 ;
;
 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是: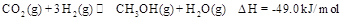
 和8molH
和8molH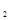 充入一容积为2L的密闭容器中,测得H
充入一容积为2L的密闭容器中,测得H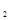 的物质的量随时间变化如右图中实线所示(
的物质的量随时间变化如右图中实线所示( 图中字母后数字表示对应的坐标):
图中字母后数字表示对应的坐标):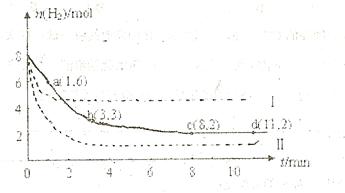
 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 体的密度不再改变
体的密度不再改变查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.+488.3kJ/mol | B.—488.3 kJ/mol |
| C.—244.15 kJ/mol | D.+244.15 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com