
科目: 来源:不详 题型:填空题
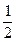 O2(g)====H2O(l)△H=-285kJ·mol-1
O2(g)====H2O(l)△H=-285kJ·mol-1 )+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1 )====H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式_________________________________________。
)====H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式_________________________________________。查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:填空题
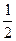 O2(g) = H2O(g) ΔH1=a kJ·mol-1?
O2(g) = H2O(g) ΔH1=a kJ·mol-1?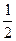 O2(g) = H2O(l) ΔH2=b kJ·mol-1??
O2(g) = H2O(l) ΔH2=b kJ·mol-1?? 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
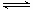 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。 __。
__。查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.879.75 kJ | B.1092 kJ | C.1759.5 kJ | D.2184 kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:| | H2(g) | Br2(g) | HBr(g) |
| 键能/kJ·mol-1 | 436 | a | 369 |
 l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。查看答案和解析>>
科目: 来源:不详 题型:单选题
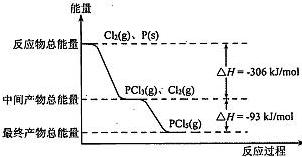
| A.其他条件不变,升高温度有利于PCl5生成 |
| B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热△H="-798" kJ/mol |
| C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H="-306" kJ/mol |
| D.其他条件不变,对于PCl5分解生成.PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.-824.4kJ·mol- 1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
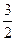 C(s)=
C(s)=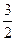 CO2(g)+2Fe(s) △H= +234.1kJ·mol-1 C(s) + O2(g) = CO2(g) △H=-39
CO2(g)+2Fe(s) △H= +234.1kJ·mol-1 C(s) + O2(g) = CO2(g) △H=-39 3.5kJ·mol-1 则2Fe(s)+
3.5kJ·mol-1 则2Fe(s)+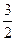 O2(g)= Fe2O3(s)的△H是
O2(g)= Fe2O3(s)的△H是
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.乙炔的燃烧热为1256kJ/mol |
| B.若转移10mol电子,则消耗2.5mol O2 |
| C.若生成2mol液态水,则△H=-2512kJ/mol |
| D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 完全燃烧,放出热量650 kJ。将反应后的二氧化碳气体缓缓通入到含有0.5 mol Ca (OH)2的澄清石灰水中充分反应。所得溶液为 。
完全燃烧,放出热量650 kJ。将反应后的二氧化碳气体缓缓通入到含有0.5 mol Ca (OH)2的澄清石灰水中充分反应。所得溶液为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com