
科目: 来源:不详 题型:单选题
| A.该NaCl溶液显酸性 | B.该NaCl溶液中Kw=1×10-14 |
| C.该NaCl溶液稀释10倍后pH=7 | D.该NaCl溶液中Kw=1×10-12 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 25.02 | 24.22 | 24.18 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| D.常温下,在Fe(OH)3悬浊液中加入足量MgCl2溶液,沉淀由红褐色转化为白色 |
查看答案和解析>>
科目: 来源:不详 题型:单选题


查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.鼓励汽车、家电“以旧换新”,可提高能源利用效率,与环境保护基本无关系 |
| B.农村大力发展沼气,将废弃的秸秆转化为清洁高效的能源 |
| C.镁铝合金可用作制造飞机的材料 |
| D.氢氧燃料电池要广泛地应用于实际生产、生活中,高容量储氢材料的研制是需解决 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
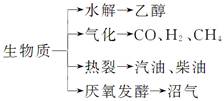
| A.①②③④⑤ | B.①②④⑤ |
| C.③④⑤ | D.①②③④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.钠米金属燃料,更易点燃 |
| B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离 |
| C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果 |
| D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
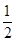 O2(g)═CO(g)△H1=-110.5kJ/mol
O2(g)═CO(g)△H1=-110.5kJ/mol| A.若碳的燃烧热用△H3表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.小烧杯内残留有水,会使测得的反应热数值偏小 |
| B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
 2H2O + 。
2H2O + 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com