
科目: 来源:不详 题型:单选题
| A.混合前CH3COONa溶液中由水电离出来的c(OH—)>1×10-7 mol·L-1 |
| B.混合前NaCl溶液中:c(Na+) + c(OH—)= c(Cl-)+c(H+) |
| C.混合溶液中 :c(Cl-) >c(CH3COOH) >c(OH—) |
| D.混合溶液中:c(Cl-) + c(CH3COO-) =0.1mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.与等体积pH=11氨水混合后所得溶液pH小于7 |
| B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.X曲线是NaOH溶液滴定盐酸,Y曲线是NaOH溶液滴定醋酸 |
| B.当NaOH溶液体积为10mL时,把甲和乙溶液混合,则存在C(Cl-) =C(Na+)>C(CH3COOH)>C(H+)>C(CH3COO-) |
| C.当滴定到pH=7的甲、乙溶液中溶液中存在:C(Cl-)= C(CH3COO-) |
| D.当NaOH溶液体积为20mL时,甲、乙溶液存在C(Cl-)= C(CH3COOH) + C(CH3COO-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
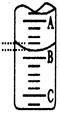
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
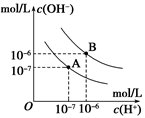
| A.A曲线代表25℃时水的电离平衡曲线 |
| B.当95℃时,pH=6的溶液呈中性 |
| C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7 |
| D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com