
科目: 来源:不详 题型:单选题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题

查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.HA可能为一元弱酸 |
| B.MOH为一元强碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)="0.01" mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

| 实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.该溶液的pH<7 |
| B.CN-的水解程度大于HCN的电离程度 |
| C.c(CN-)+c(HCN)=0.02 mol·L-1 |
| D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c(Na+)-c(X-)=9.9×10-7mol·L-1 |
| B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1 |
| C.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1 |
| D.混合溶液中由水电离出的c(OH-)=10-8mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于( )A.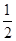 lg( lg(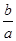 ) ) | B.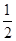 lg( lg(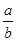 ) ) |
C.14+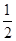 lg( lg(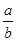 ) ) | D.14+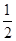 lg( lg(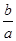 ) ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com