
科目: 来源:不详 题型:单选题
| A.K+的物质的量为0.1 mol |
| B.SO42-的物质的量为0.2mol |
| C.K+的物质的量浓度为0. 1mol·L-1 |
| D.SO42-的物质的量浓度为0. 1mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.1.5mol/L | B.0.75mol/L | C.0.5mol/L | D.0.25mol/L |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.该温度下,0.0lmol/L醋酸溶液的pH=4 |
| B.该温度下,用0.1mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10 |
| C.该温度下,0.01mol/L醋酸溶液中由水电离出的c(H+)=10-11mol/L |
| D.该温度下,0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液中c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是查看答案和解析>>
科目: 来源:不详 题型:单选题
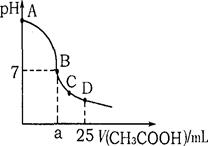
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
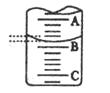
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.10-2 mol/L | B.10-12 mol/L |
| C.2×10-12 mol/L | D.0.02mol/L |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.05 mol·L-1的H2SO4溶液,pH=1 |
| B.0.001 mol·L-1的NaOH溶液,pH=11 |
| C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 |
| D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com