
科目: 来源:不详 题型:单选题
| A.pH=2与pH=1的硝酸中c(H+)之比 |
| B.Na2CO3溶液中c(Na+)与c(CO32ˉ )之比 |
| C.0.2mol/L与0.1mol/L醋酸中c(H+)之比 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.pH等于1的HNO3与pH等于13的Ba(OH)2溶液等体积混合后,溶液pH为7 |
| B.pH等于3的盐酸稀释105倍后,溶液pH接近于7 |
| C.0.01mol/L的CH3COOH溶液pH大于2漂白性 |
D.pH等于10和pH等于12的两种NaOH溶液等体积混合后,溶液中的c(H+)等于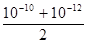 mol/L mol/L |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0︰1︰12︰11 | B.14︰13︰12︰11 | C.14︰13︰2︰3 | D.1︰10︰100︰1000 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
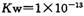 ,下列叙述正确的是
,下列叙述正确的是| A.700C时,向纯水中加人H3PO4后,水的Kw减小 |
B.700C的Na2CO3溶液中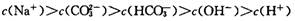 |
C.700C的H2S04溶液中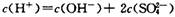 |
D.将室温下0.1 mol/L的NaOH溶液加热至700C时,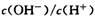 随之增大 随之增大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 编号 | HX | YOH | 溶液的体积关系 |
| A[ | 强酸 | 强碱 | V(HX)=V(YOH) |
| B | 强酸 | 强碱 | V(HX)<V(YOH) |
| C | 强酸 | 弱碱 | V(HX)=V(YOH) |
| D | 弱酸 | 强碱 | V(HX)=V(YOH) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.1 mol/L氨水中:c(NH4+) + c(H+) = c(OH-) |
| B.0.1 mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-) |
| C.同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+) + 2c(NH3·H2O) = 2c(SO42-) |
| D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-) = c(H+) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2 O2(g)===H2O(g) △H =" -241.8" kJ·mol-1
O2(g)===H2O(g) △H =" -241.8" kJ·mol-1
查看答案和解析>>
科目: 来源:不详 题型:实验题
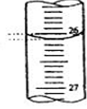
| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.80 | 23.10 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com