
科目: 来源:不详 题型:单选题
 1 kJ/mol
1 kJ/molA.碳的燃烧热大于110.5 kJ/ mol mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀Ba(OH)2溶液反应生成1mol水放出的热量为57.3 kJ |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量少于57.3 kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①④⑥ | B.①②③④ | C.①④⑤⑥ | D.全部 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 离的c(OH-)为
离的c(OH-)为A.③ | B.④ | C.①或③ | D.③或④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c=0.10×(V1+V2+V3)/3×20.00mol·L-1 | B.c=0.10×(V1+V2)/2×20.00 mol·L-1 |
| C.c=0.10×(V1+V3)/2×20.00 mol·L-1 | D.c=0.1 0×V1/20.00 mol·L-1 0×V1/20.00 mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 ,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是| A.结合H+的能力:Y―>CO32―>X―>HCO3― |
| B.酸性由强至弱:HX>HY>H2CO3 |
C.溶液物质的量浓度 相同时碱性:NaX>Na2CO3>NaY>NaHCO3 相同时碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度:c(X―)>c(Na+)>c(HCO3―)>c(OH―) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
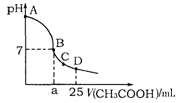
查看答案和解析>>
科目: 来源:不详 题型:实验题
 a(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
a(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。| A.托盘天平 | B.容量瓶 | C.酸式滴定管 | D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 离出的H+浓度由大到小的顺序是 (填序号)。
离出的H+浓度由大到小的顺序是 (填序号)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com