
科目: 来源:不详 题型:单选题
| A.该反应为吸热反应 | B.该反应为放热反应 |
| C.断裂H-H键放出能量 | D.生成H-O键吸收能量 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
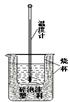
查看答案和解析>>
科目: 来源:不详 题型:填空题

| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.过氧化钠与水反应 | B.氨水与稀硫酸的反应 |
| C.灼热的炭与CO2反应 | D.Ba(OH)2·8H2O与NH4Cl 的反应 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.吸热反应一定要高温才能发生 |
| B.1mol酸与碱恰好中和时所放出的热量叫中和热 |
| C.已知C(s,石墨)=C(s,金刚石) △H=+1.9 kJ/mol,则石墨比金刚石稳定 |
| D.已知2H2(g)+O2(g)=2H2O(g) △H= —483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
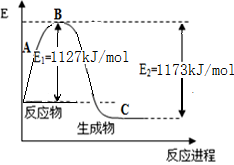
查看答案和解析>>
科目: 来源:不详 题型:填空题

 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.194 | B.391 | C.516 | D.658 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com