
科目: 来源:不详 题型:填空题
 2NH3+O2
2NH3+O2| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |

 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:查看答案和解析>>
科目: 来源:不详 题型:单选题
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 2SO3 ΔH=-196.6 kJ·mol-1 |
| B.C(g)+O2(g)=CO(g) ΔH=393.5 kJ·mol-1 |
C.H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ O2(g)=H2O(g) ΔH=-241.8 kJ |
| D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
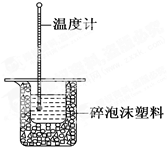
查看答案和解析>>
科目: 来源:不详 题型:填空题



查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.需要加热方能发生的反应一定是吸热反应 |
| B.若反应为放热反应,则该反应不必加热就可发生 |
| C.放热反应比吸热反应容易发生 |
| D.化学反应都伴随着能量的变化 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个 |
| B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个 |
| C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个 |
| D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.生成物总能量一定低于反应物总能量 |
| B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
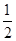 O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )| A.485.5 kJ/mol | B.610 kJ/mol |
| C.917 kJ/mol | D.1 220 kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 O2(g)=CO2(g)ΔH2=-283 kJ/mol
O2(g)=CO2(g)ΔH2=-283 kJ/mol O2(g)=CO(g)ΔH3=?
O2(g)=CO(g)ΔH3=?| A.CO的燃烧热为283 kJ/mol |
| B.二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C.ΔH3=ΔH2-ΔH1=110.5 kJ/mol |
| D.ΔH3=ΔH1-ΔH2=-110.5 kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 |
| C.ΔH1=ΔH2 | D.无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com