
科目: 来源:不详 题型:单选题
| A.发生分解反应的反应物的总能量一定低于生成物的总能量 |
| B.物质发生化学变化一定伴随着能量变化,且能量形式只表现为热量变化 |
| C.把石墨完全转化为金刚石时,要吸收能量,所以石墨不如金刚石稳定 |
| D.原子结合成分子的过程一定释放出能量 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
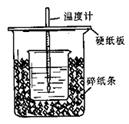
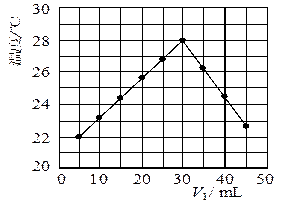

 溶液的浓度应为 mol/L。
溶液的浓度应为 mol/L。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| B.氢气的燃烧热为285.8kJ · mol-1,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(g)△H=-285.8 kJ· mol-1 |
| C.吸热反应都需加热才能完成 |
| D.热化学方程式的化学计量数只表示物质的量,不表示物质的分子数或原子数 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
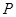 )和
)和 发生反应生成
发生反应生成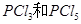 ,反应过程和能量关系如下图所示,图中的△H表示生成
,反应过程和能量关系如下图所示,图中的△H表示生成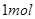 产物的数据。已知
产物的数据。已知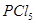 分解生成
分解生成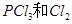 ,该分解反应是可逆反应,下列说法正确的是
,该分解反应是可逆反应,下列说法正确的是
A.其他条件不变,升高温度有利于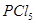 的生成 的生成 |
B.反应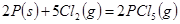 对应的反应热 对应的反应热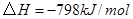 |
C.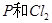 反应生成 反应生成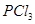 的热化学方程式为: 的热化学方程式为: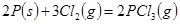 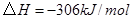 |
D.其他条件不变,对于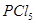 分解生成 分解生成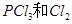 的反应,增大压强, 的反应,增大压强, 的转化率减小,平衡常数K减小 的转化率减小,平衡常数K减小 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.2SO2+ O2 2SO3;△H=-196.6kJ/mol 2SO3;△H=-196.6kJ/mol |
| B.N2(g) + 2O2(g) ="=" 2NO2(g);△H= +67.7kJ/mol |
| C.C(s) + O2(g) ="=" CO2(g);△H=" +393.5kJ/mol" |
| D.H2O(l) ="=" H2(g)↑+ 1/2O2(g)↑;△H= +285.8kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 列说法或表示方法中正确的是( )
列说法或表示方法中正确的是( )| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH="+1.9KJ/mol" ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.在稀溶液中:H+( aq )+OH-( aq)=H2O(l);ΔH="-57.3KJ/mol" ,若将0.5 mol浓H2SO4溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。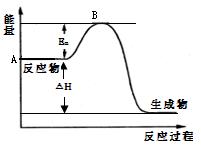
 H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。查看答案和解析>>
科目: 来源:不详 题型:填空题
 化还原NOx也可以消除氮氧化物的污染。例如:
化还原NOx也可以消除氮氧化物的污染。例如:查看答案和解析>>
科目: 来源:不详 题型:单选题
A.废旧电池应集中 回收,并填埋处理 回收,并填埋处理 |
| B.充电电池放电时,电能转变为化学能 |
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有 关 关 |
| D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。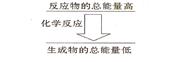

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com