
科目: 来源:不详 题型:单选题

 N2(g) + 2 CO2(g) △H = kJ/mol。
N2(g) + 2 CO2(g) △H = kJ/mol。 2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.此反应为放热反应 |
| B.断裂石墨的化学键需要吸收的能量小于形成金刚石的化学键放出的能量 |
| C.石墨比金刚石稳定 |
| D.此反应为物理变化 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.已知2H2(g)+O2(g)===2H2O(g);ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B.C(石墨,s)===C(金刚石,s);ΔH>0,所以金刚石比石墨稳定 |
| C.已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成一氧化碳时ΔH=(0.5y-2.5x)kJ/mol |
| D.己知2C(s)+2O2(g)===2CO2(g);ΔH1 2C(s)+O2(g)===2CO(g);ΔH2,则ΔH1>ΔH2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.O2和O2互为同位素,性质相似 |
| B.常温下,pH=1的水溶液中Na+、NO、HCO、Fe2+可以大量共存 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D.硝酸铵溶于水是一个吸热过程,但常温下却能自发进行,说明ΔS>0 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
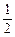 O2(g)=CO2(g) ΔH3<0 ③
O2(g)=CO2(g) ΔH3<0 ③ 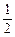 O2(g)=H2O(g) ΔH4<0 ④
O2(g)=H2O(g) ΔH4<0 ④查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com