
科目: 来源:不详 题型:单选题
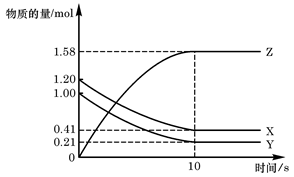
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始到10s, X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s, Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+ Y(g) Z(g) Z(g) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
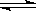 C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
| A.①② | B.①③ | C.②③ | D.③④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)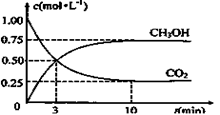
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加入碳酸钠固体 | B.改用18 mol/L的浓H2SO4 |
| C.滴入少量硫酸铜溶液 | D.加入硫酸钾溶液 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:单选题
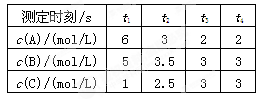
 2C
2C查看答案和解析>>
科目: 来源:不详 题型:填空题
 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com