
科目: 来源:不详 题型:单选题
 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x为( )
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x为( )| A.(NH3) =" 0.002mol·(L·s)" –1 | B.(NO) =" 0.008mol·(L·s)" –1 |
| C.(H2O) =" 0.006mol·(L·s)" –1 | D.(O2) =" 0.01mol·(L·s)" –1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: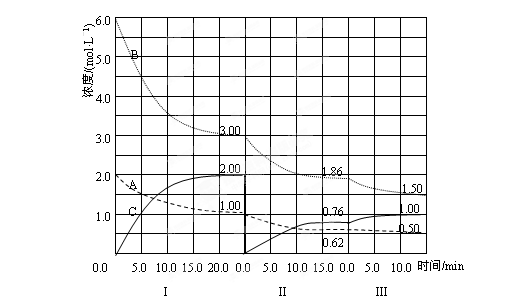
 的方向是_________,采取的措施是________;
的方向是_________,采取的措施是________; 和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”),判断的理由是_________________________________________;
和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”),判断的理由是_________________________________________;  随时间变化的趋势(曲线上必须标出A、B、C)。
随时间变化的趋势(曲线上必须标出A、B、C)。
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为
2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为| A.4 mol/L | B.2mol/(L·min) | C.6 mol/(L·min) | D.3mol/(L·min) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (表示反应物的消耗速率或生成物的生成速率)为( )
(表示反应物的消耗速率或生成物的生成速率)为( ) A. = 0.01 mol / (L·s) = 0.01 mol / (L·s) | B. = 0.008 mol / (L·s) = 0.008 mol / (L·s) |
C. = 0.003 mol / (L·s) = 0.003 mol / (L·s) | D. = 0.004 mol / (L·s) = 0.004 mol / (L·s) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 4NO(g) + 6H2O(g) 在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x
4NO(g) + 6H2O(g) 在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x . (NH3) =" 0.008mol·(L·s)" –1
. (NH3) =" 0.008mol·(L·s)" –1查看答案和解析>>
科目: 来源:不详 题型:填空题
 XQ(g)+3R(g),在容积为4L的密闭容器中,将2mol气体N和3mol气体M混合,当反应经2min后
XQ(g)+3R(g),在容积为4L的密闭容器中,将2mol气体N和3mol气体M混合,当反应经2min后 达平衡时生成2.4 mol气体R,并测得Q的浓度为0.4mol/L,则X的值为 ,M的转化率为 ,用M物质表示的反应速率vM=
达平衡时生成2.4 mol气体R,并测得Q的浓度为0.4mol/L,则X的值为 ,M的转化率为 ,用M物质表示的反应速率vM= 查看答案和解析>>
科目: 来源:不详 题型:填空题
 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);查看答案和解析>>
科目: 来源:不详 题型:填空题
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1[ | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:单选题
 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com