
科目: 来源:不详 题型:单选题
| A.0.04 | B.0.04 mol/(L.s) | C.0.8 mol/(L.s) | D.0.04 mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

 。
。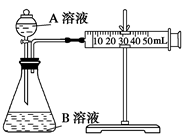
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
 mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。查看答案和解析>>
科目: 来源:不详 题型:填空题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
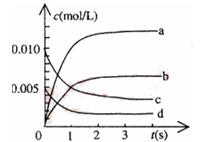
查看答案和解析>>
科目: 来源:不详 题型:填空题
 I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为: (g)
(g)  2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题: 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入NH3的物质的量 |
| y | NH3的物质的量 | 平衡常数K | NH3的转化率 | 生成物物质的量总和 |
| | 0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | --------- |
| 实验2 | 5 | 5 | 40 | 25 | ---------- |
| 实验3 | 5 | 5 | V2 | 0 | ----------- |
 H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率 与时间t的关系如右图。
与时间t的关系如右图。 ;
;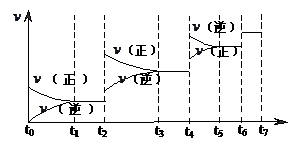
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的平均反应速率为
2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的平均反应速率为| A.1.2mol·(L·min)-1 | B.0.6 mol·(L·min)-1 |
| C.1.0 mol·(L·min)-1 | D.0.4 mol·(L·min)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com