
科目: 来源:不详 题型:单选题
 2SO3,反应开始时,反应速率由大到小排列顺序正确的是
2SO3,反应开始时,反应速率由大到小排列顺序正确的是| 容器 | 温度 | SO2(mol) | O2(mol) | 催化剂 |
| 甲 | 500℃ | 10 | 5 | - |
| 乙 | 500℃ | 10 | 5 | V2O5 |
| 丙 | 450℃ | 8 | 5 | - |
| 丁 | 500℃ | 8 | 5 | - |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.温度不变时,增大反应物浓度可能增大活化分子的分子数 |
| B.其他条件不变时,升高温度能使分子获得更高的能量,活化分子百分数提高 |
| C.其他条件不变时,对于有气体参与和生成的反应而言,增大体系的压强能增大单位体积内的活化分子百分数 |
| D.其他条件不变时,加人正催化剂能提高反应体系中含有的活化分子百分数 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.乙、甲、丁、丙 | B.乙、申、丙、丁 |
| C.甲、乙、丙、丁 | D.丁、丙、乙、甲 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变 |
| B.0.1mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
C.对于N2(g)+3H2(g) 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 |
| D.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
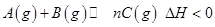 ,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是
,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是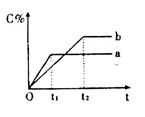
| A.反应由逆反应开始 |
| B.a表示有催化剂,b表示无催化剂 |
| C.若n=2,其它条件相同,a比b的压强大 |
| D.若其它条件相同,a比b的温度高 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
| A.若平衡常数K值变大,平衡移动时v逆先减小后增大 |
| B.容器中固体物质的质量不再改变,则反应到达平衡状态 |
| C.若x表示温度,y可表示平衡时混合气体的密度 |
| D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为| A.v正 增大,v逆减小 | B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 | D.v正和v逆不同等程度的减小 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

| 编号 | 电极材料 | 电解质溶液 | 电子流动方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2SO3是接触法制硫酸工艺中的重要反应,下列关于该反应的说法中错误的是
2SO3是接触法制硫酸工艺中的重要反应,下列关于该反应的说法中错误的是| A.增加SO2的浓度能加快该反应的速率 |
| B.通常使用铁作催化剂 |
| C.降低体系温度会减慢该反应的速率 |
| D.使用催化剂能改变该反应的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com