
科目: 来源:不详 题型:单选题
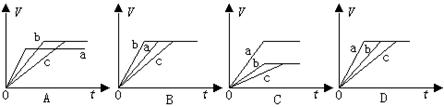
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2NO在密闭容器中进行,下列条件中哪些能加快该反应的反应速率(假定温度不变) ( )
2NO在密闭容器中进行,下列条件中哪些能加快该反应的反应速率(假定温度不变) ( )| A.缩小体积使压强增大 | B.体积不变充入N2使压强增大 |
| C.体积不变充入He气使压强增大 | D.减小压强使体积增大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①③④⑤ | B.①②④⑤ | C.①②③④ | D.①②④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.催化剂能改变化学反应的速率 |
| B.一定条件下的可逆反应,反应物的转化率不可能达到100% |
| C.有气体参加的反应,通过压缩体积增大压强,可以使反应速率增大 |
| D.当化学反应达到其最大限度时,反应就停止了 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加入一定量的CaCl2 |
| B.加入一定量的CaCO3 |
| C.加入15mL0.5mol/L的盐酸 |
| D.加入5mLH2O |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和 探究温度对该反应速率的影响; c. 实验①和 探究催化剂对该反应速率的影响。 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
| 实验编号 | 溶液褪色所需时间 t / min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2NH3反应,起始时N2和H2分别为10mol和30mol,当达到平衡时N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是( )
2NH3反应,起始时N2和H2分别为10mol和30mol,当达到平衡时N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是( )| A.40mol、35% | B.20mol、30% | C.20mol、70% | D.10mol、50% |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是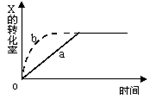
| A.增大体积 | B.增大Y的浓度 |
| C.降低温度 | D.缩小体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com