
科目: 来源:不详 题型:填空题

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)查看答案和解析>>
科目: 来源:不详 题型:填空题
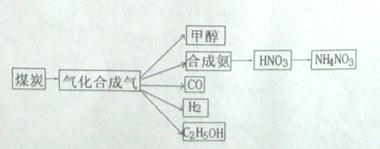
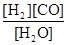 ,它所对应的化学反应为:
,它所对应的化学反应为:  2C0(g),K1 ①
2C0(g),K1 ① H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ② CO(g)+H2(g),K3 ③
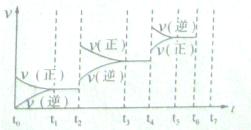
CO(g)+H2(g),K3 ③ K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )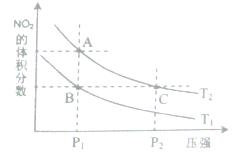
查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:填空题
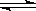 H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O 的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题: 低)。高压锅中水的沸点比普通锅中水的沸点 (填高或低)。
低)。高压锅中水的沸点比普通锅中水的沸点 (填高或低)。查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:填空题

 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 .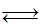 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g)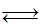 CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为: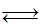 CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 收。
收。查看答案和解析>>
科目: 来源:不详 题型:填空题
 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy ,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;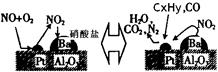
 2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠ 2H2O(g) K2=2×1081 ㈡
2H2O(g) K2=2×1081 ㈡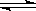 2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
+O2(g) 平衡常数K= ;A. 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 |
| B.若升高温度,反应㈢的平衡常数K3将增大 |
| C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大 |
| D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应:2CO(g)+2NO(g) |
| B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| C.铅蓄电池放电时,正极和负极均有硫酸铅生成 |
D.反应:2A(g)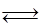 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是
pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是| A.C的体积分数下降 |
| B.a + b > p |
| C.正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D.正反应速率和逆反应速率均加大,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.25% | B.40% | C.35% | D.80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com