
科目: 来源:不详 题型:填空题
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。  CO2转化率(%) CO2转化率(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
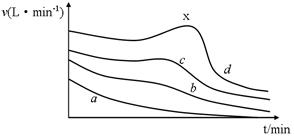
查看答案和解析>>
科目: 来源:不详 题型:计算题
 N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:查看答案和解析>>
科目: 来源:不详 题型:单选题
 2SO3(g);
2SO3(g); 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量 :Q3 :Q3 |
 )
)| A.Q1=Q2=Q3="197" kJ |
| B.达到平衡时,丙容器中SO2的体积分数最大 |
| C.甲、乙、丙3个容器中反应的平衡常数相等 |
| D.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2NH3(g)的△H= 。
2NH3(g)的△H= 。 积分数为 。
积分数为 。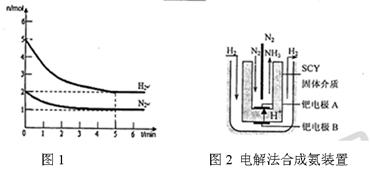
 内外
内外 表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A
表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A 上发生的电极反应式是 。
上发生的电极反应式是 。 查看答案和解析>>
科目: 来源:不详 题型:单选题
 CO2(g)+N2(g),己知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是 ( )
CO2(g)+N2(g),己知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是 ( )| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.提高尾气净化效率的最佳途径是研制高效催化剂 |
| D.570K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
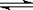 CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①④⑥ | B.②③⑤ | C.①③⑥ | D.②③⑥ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.H2(g)+ I2(g)===2HI(g)(正反应是放热反应) |
| B.NH4HCO3===NH3+H2O+CO2(正反应是吸热反应) |
| C.2NO2===N2O4(正反应是放热反应) |
| D.3O2===2O3 (正反应是吸热反应) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.升高温度、降低压强、增加氮气 | B.降低温度、增大压强、加入催化剂 |
| C.升高温度、增大压强、增加氮气 | D.降低温度、增大压强、分离出部分氨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com