
科目: 来源:不详 题型:单选题
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原困是增加了活化分子的百分数 |
C.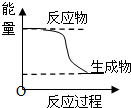 某化学反应的能量变化如图所示,则该反应的△H>0.△S>0 |
| D.H3PO4的电离常数:Kal>>Ka2>>Ka3 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数增大 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 一定条件 |
| n(CH3OH) |
| n(CO2) |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 9 |
| 10 |

查看答案和解析>>
科目: 来源:不详 题型:填空题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.2 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.K只与温度有关,温度不变,K不变 |
| B.改变条件,反应物的转化率增大,K也一定增大 |
| C.温度一定时,其正、逆反应的K相等 |
| D.若正反应△H<0,升高温度,该反应的K增大 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 体系 | c(SO2)mol/L | c(O2)mol/L | c(SO3)mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.00 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.300 | 0.0400 | 1.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com