
科目: 来源:不详 题型:单选题
| A.反应过程中,两个烧杯中产生氢气的速率一直相等 |
| B.反应结束后,两个烧杯中产生氢气的物质的量相等 |
| C.反应结束后,乙烧杯中有镁粉剩余 |
| D.反应结束后,甲烧杯中溶液呈中性 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | K1=4.30×l0-7 | K1=1.54×l0-2 | K=2.95×l0-8 |
| K2=5.61×l0-11 | K2=1.02×l0-7 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多 |
| B.氯化钠溶液呈中性,醋酸钠溶液呈碱性 |
| C.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
| D.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 NH4++OH-对于该平衡,下列叙述正确的是
NH4++OH-对于该平衡,下列叙述正确的是| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向逆反应方向移动 |
| C.加入少量 0.1 mol·L-1盐酸,溶液中c(H+)减小 |
| D.加入少量NH4Cl固体,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
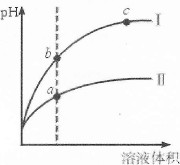
| A.Ⅱ为盐酸稀释时的pH变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点Kw的数值比c点Kw的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.1mol/L的氨水可使酚酞试液变红 |
| B.0.1mol/L的氯化铵溶液的pH约为5 |
| C.在相同条件下,氨水溶液的导电性比强碱溶液弱 |
| D.铵盐受热易分解 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
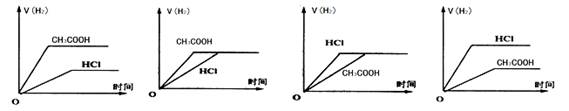
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com