
科目: 来源:不详 题型:单选题
| A.熔化时不导电 |
| B.不是离子化合物,而是极性共价化合物 |
| C.溶液中已电离的离子和未电离的分子共存 |
| D.水溶液的导电能力很差 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.1mol/LHCOOH溶液中:c(HCOO-)+c(OH-) = c(H+) |
| B.1L0.1 mol/LCuSO4·(NH4)2SO4·6H2O的溶液中c(SO42->c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
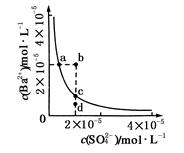
| A.NH3·H2O的电离程度减小 | B.NH3·H2O的电离常数增大 |
| C.溶液的导电能力不变 | D.溶液的pH增大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
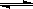 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c(CH3COOH)=0.01mol·L-1 |
| B.c(H+)=c(CH3COO-) |
| C.加水稀释100倍后,溶液pH=4 |
| D.加入醋酸钠固体,可抑制醋酸的电离 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.柠檬酸的电离会抑制碳酸的电离 |
| B.该碳酸饮料中水的电离受到抑制 |
| C.常温下,该碳酸饮料中KW的值大于纯水中KW的值 |
| D.打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.中和时所需NaOH的量 | B.电离的程度 |
| C.H+的物质的量浓度 | D.CH3COOH的物质的量 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
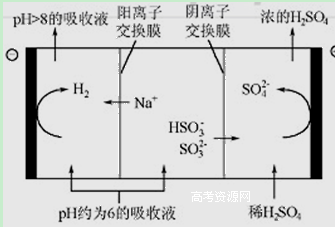
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.溶液中导电粒子的数目减少 |
B.溶液中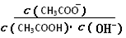 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH <7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com