
科目: 来源:不详 题型:填空题
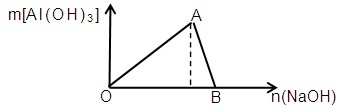
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c(F-)>c(OH-)>c(HCN)>c(HF) | B.c(F-)+c(HF)>c(CN-)+ c(HCN) |
| C.c(OH-)>c(F-)>c(CN-)>c(H+) | D.c(OH-)>c(HF)>c(HCN)>c(H+) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.同温、同浓度的钠盐溶液PH:NaA>NaB |
| B.PH相同的HA,HB的酸溶液,稀释相同倍数后,PH:HA<HB |
| C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多 |
| D.同温、同浓度的两种酸溶液,HA的电离程度大于HB的电离程度 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n |
| B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 |
| C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多 |
| D.两种酸溶液中c(CH3COO-)=c(Cl-) |
查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
 4— ; HSO4—
4— ; HSO4— H++SO42—,回答下列问题:
H++SO42—,回答下列问题: 方程式表示) 。
方程式表示) 。A.c  (SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 (SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 |
| B.c(OH-)=c(H+)+c(HSO4—) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)=2c(SO42—)+2c(HSO4—) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
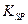 =2.6×10-39,Mg(OH)2的溶度积常数
=2.6×10-39,Mg(OH)2的溶度积常数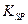 =5.6×
=5.6×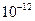 ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;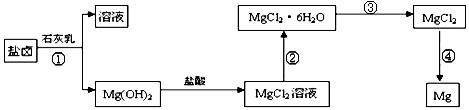
 .过程③的转化需要在HCl气流中加热,HCl的作用是
.过程③的转化需要在HCl气流中加热,HCl的作用是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com